1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12
Необходимость проведения контроля
Окончательный результат определения чувствительности диско-диффузионным методом зависит от множества факторов. Такие, как посевная доза и температура инкубации, легко контролировать. Другие (состав питательных сред, содержание антимикробного вещества в диске) контролю в лабораторных условиях не подлежат. Поэтому результаты определения чувствительности должны быть объектом постоянного мониторинга, являющегося элементом программы контроля качества (непосредственно программа контроля качества в данной брошюре не рассматривается).
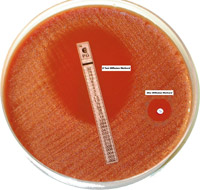
Точность и аккуратность выполнения определения чувствительности контролируется путем параллельного использования контрольных штаммов с известной чувствительностью к антимикробным агентам. Контрольные штаммы исследуют точно по такой же методике, что и микроорганизмы, выделенные от больных. Размеры зон задержки роста, выявленные в тестах с контрольными микроорганизмами, должны находиться в пределах тех диаметров, которые представлены в Приложениях 2А и 2Б. Если результаты регулярно не совпадают с этими параметрами, их следует рассматривать как свидетельство технической ошибки или неудовлетворительного качества питательных сред или дисков. Каждый компонент и каждый этап теста на определение чувствительности следует подвергнуть исследованию для выявления причины ошибки и устранения ее.
Стандартная методика контроля качества
В программах контроля качества при определении чувствительности к антибиотикам следует использовать референс-штаммы тех же видов бактерий, которые изучают параллельно в тестах с «клиническими» культурами. Эту процедуру целесообразно осуществлять при использовании новой партии агара Мюллера-Хинтона или дисков.
Стандартные штаммы для контроля качества . Наиболее часто используют штаммы: Staphylococcus aureus (АТСС 25923), Escherichia coli (АТТС 25922), Pseudomonas aeruginosa (АТСС 27853). Культуры могут быть получены из национальных хранилищ живых культур. Они доступны на коммерческой основе в форме флаконов или ампул с высушенной чистой культурой. Культуры для каждодневного использования следует выращивать на скошенном питательном агаре (для этих целей подходит триптон-соевый агар) и хранить в холодильнике. Пересевы культур на свежий скошенный агар следует осуществлять каждые 2 недели.
Питательная среда . Чтобы гарантировать достаточную надежность метода измерения размеров зоны задержки роста при исследовании чувствительности к сульфаниламиду и ко-тримоксазолу, агар Мюллера- Хинтона должен содержать пониженные концентрации тимидина и тимина. Поэтому каждую новую партию агара МюллераХинтона следует проверять с использованием контрольного штамма Enterococcus faecalis (АТCС 29212 или 33186) и диска с котримоксазолом или использовать агар Мюллера-Хинтона №2. Партии удовлетворительного качества дают отчетливую зону задержки роста диаметром 20 мм или более, которая совершенно свободна от какого-либо неясного бактериального роста или отдельных колоний.
Посев материала . Культуры можно сеять в бульоны любых типов и инкубировать до тех пор, пока в бульоне не появится микробный рост (помутнение). Каждый бульон пересевают штрихом на чашку с агаром и инкубируют в течение суток. Затем следует отобрать единичные колонии и направить их для определения чувствительности по методике, описанной в разделе «Методика исследования».
Расположение дисков с антимикробными агентами . После посева культуры на чашку с агаром на нее укладывают соответствующие диски, как это описано в данной главе в разделе «Методика исследования». Диски, которые следует подобрать для каждого конкретного штамма, перечислены в табл.2 и Приложении 1.
Учет результатов. После инкубирования посевов в течение 16-18 ч следует измерить диаметры зон задержки роста. Результаты измерений и дату проведения анализа заносят в специальную карточку контроля качества. В такой карточке фиксируют информацию по каждой комбинации «диск-штамм». Карточка представляет собой график, на котором по оси ординат в масштабе фиксируют размер (диаметр) зоны задержки роста, по оси абсцисс дату проведения анализа. В том случае, когда размеры зон оказываются вне предусмотренных пределов, следует принять меры для улучшения качества проведения исследования. Выраженные отклонения результатов, которые нельзя объяснить техническими ошибками в методике, могут свидетельствовать о загрязнении образцов посторонней микрофлорой, либо о внезапном изменении чувствительности или ростовых характеристик контрольного штамма. Если это происходит, следует получить свежий штамм из надежного источника.