1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12
Учитывая то, что признак подвержен фенотипическим и генотипическим изменениям, чувствительность к антибиотикам желательно проверять у свежевыделенных чистых культур, выделенных из материала до начала антибиотикотерапии, и повторять исследование с культурами, выделенными в ходе лечения.
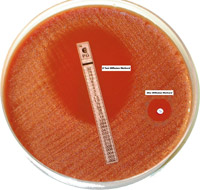
Величина посевной дозы
Если посев слишком скудный, зона задержки роста будет больше, хотя чувствительность микроорганизма неизменна. Относительно устойчивый штамм в этом случае может быть учтен как чувствительный. Наоборот, если посев слишком плотный, размер зоны задержки роста уменьшен, и чувствительный штамм может быть учтен как устойчивый. Обычно оптимальные результаты получают, когда величина посевной дозы обеспечивает почти сливной рост.
В том случае, когда чашки, засеянные штаммом, в отношении которого проводиться тестирование, оставляют при комнатной температуре на срок, превышающий установленное стандартом время, размножение посеянного микроорганизма может начаться еще до аппликации диска с антибиотиком. Это приводит к уменьшению диаметра зоны задержки роста, вследствие чего при учете результатов чувствительный штамм будет учтен как устойчивый.
Температура инкубации
При выполнении теста на определение чувствительности инкубацию обычно проводят при температуре 35-37°С, которая является оптимальной для роста. При более низкой температуре необходимо больше времени для эффективного роста культуры, в результате чего зона задержки роста будет больше. Когда исследованию в отношении метициллина (оксациллина) подвергают обладающий гетерогенной устойчивостью штамм S. aureus , резистентная часть популяции может быть выявлена при температуре 33-35°С. При более высоких температурах вся популяция дает рост, который интерпретируют как чувствительность. При температурах 35°С и ниже устойчивые колонии вырастают внутри зоны задержки роста. Эти устойчивые колонии легче определить, если чашки до учета результатов оставить на несколько часов при комнатной температуре. Такие колонии обязательно следует идентифицировать, чтобы выяснить, не принадлежат ли они контаминирующей микрофлоре.
Время инкубации
Большинство методик рекомендует время инкубации 16-18 ч. При острой необходимости, однако, предварительный учет результатов может быть проведен через 6 ч. При обычной рутинной работе этого делать не рекомендуется, результаты всегда следует подтверждать после инкубации, проведенной с соблюдением необходимого времени.
Размер чашки , толщина агарового слоя среды и расположение дисков с антибиотиками
Обычно определение чувствительности проводят на чашке диаметром 90-100 мм, помещая 6-8 дисков на одну чашку. Если необходимо определить чувствительность к большему числу антибиотиков, следует использовать две чашки или одну чашку диаметром большего размера. Незначительные изменения глубины агарового слоя не оказывают существенного влияния. Однако, когда толщина агарового слоя существенно отличается от рекомендованной в ту или иную сторону, результаты исследования будут недостоверными. Правильное расположение дисков является необходимым условием и позволяет избежать частичного совпадения зон задержки роста разных дисков или деформации зон у края чашки.
Содержание препарата в диске
Диаметр зоны задержки роста зависит от количества лекарственного препарата в диске. Если во время хранения дисков произошло снижение содержания препарата в результате разрушения активного вещества, размер зоны задержки роста будет соответственно меньше, что даст ошибочный результат определения чувствительности.
Состав питательной среды
Питательная среда оказывает влияние на размер зоны за счет своих ростовых свойств в отношении конкретных видов микроорганизмов, скорости диффузии антибиотиков и активности ингредиентов. Использование стандартной и качественной питательной среды для определенного метода является необходимым составным элементом правильного исследования.
рН. Необходимо контролировать рН каждой серии агара Мюллера-Хинтона. В значительной степениточность используемого метода зависит от типа оборудования, имеющегося в лаборатории. После охлаждения до комнатной температуры агар должен иметь рН 7,2-7,4. Если значение рН слишком низкое, некоторые препараты могут потерять свою активность (например, аминогликозиды, макролиды). При слишком высоких значениях рН можно ожидать противоположные результаты исследования. Для контроля рН можно использовать метод погружения электродов или специальный поверхностный электрод.
Влажность. Если перед посевом в чашке со средой имеется поверхностная влага, их надо поместить сприоткрытыми крышками (обычно на 10-30 минут) в термостат (35-37°С). Поверхность агара должна быть влажной, но не с капельками влаги, которые также должны отсутствовать на крышке чашки Петри.
Тимидин и тимин . Среда с избытком тимидина или тимина, может подавлять антимикробную активность сульфаниламидов и триметоприма вплоть до получения малых зон, и, соответственно, ложного заключения об устойчивости к указанным препаратам. В этих случаях рекомендуется применять среды с малым количеством тимидина. Помимо агара МюллераХинтона, для определения чувствительности к сульфаниламидам и другим химиопрепаратам выпускаются такие среды, как агар DST, а также бульонные среды. Для контроля новой партии агара необходимо исследовать чувствительность к триметоприму и сульфаметоксазолу Enterococcus faecalis АТСС 33186. Непригодным считается агар, если зона задержки роста отсутствует или ее диаметр меньше 20 мм.
Двухвалентные катионы. Различные двухвалентные катионы, преимущественно Mg2+ и Ca2+ , влияют на результаты исследований аминогликозидов и тетрациклинов со штаммами Pseudomonas aeruginosa .
Чрезмерное содержание катиона может приводить к неприемлемо большим зонам задержки роста. Ионы цинка могут влиять на чувствительность к карбапенемам. Поэтому необходимо использовать соответствующие среды, например, среду Мюллера-Хинтона №2.
Приведенные данные указывают на множество факторов, влияющих на размер зоны задержки роста, способных привести к получению отличающихся друг от друга результатов в отношении одного и того же микроорганизма. Это еще раз подчеркивает необходимость стандартизации диско-диффузионного метода. Лишь при соблюдении основополагающих принципов и точном выполнении требований методики будут получены достоверные результаты. Произвольное изменение любого из факторов, имеющих значение для определения чувствительности, может привести к сообщению клиницистам искаженных (необъективных) результатов исследования. За точным и аккуратным соблюдением методики работы следует установить постоянный контроль (схема контроля качества описана ниже). При выявлении любых отклонений следует немедленно принять меры для устранения ошибок. Возникающие на практике проблемы контроля определения антибиотикочувствительности и методы их решения суммированы в Приложении 7