1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12
Основные понятия и критерии
При использовании антибиотиков и других химиотерапевтических препаратов (ХТП) на практике важно определять чувствительность к ним клинически значимых штаммов микроорганизмов. Чувствительность микроорганизмов необходимо определять в каждом случае выявления инфекции и периодически - в ходе лечения. С этой целью применяют несколько методов исследования: диско-диффузионный, метод серийных разведений, метод Е-тестов, пограничных концентраций и другие.
Главным показателем чувствительности, независимо от метода ее определения, является величина минимальной ингибирующей концентрации - МИК (мкг/мл), т. е. минимальная концентрация ХТП, задерживающая видимый рост испытуемого штамма микроорганизма в стандартном опыте. Величину МИК определяют методом серийных разведений (в бульоне или агаре) или градиентными диффузионными методами в агаре (Е-тестами или стрипами ХайКомб).
Критерием чувствительности условно является величина терапевтического индекса (Т):
Т= МИК/К, где К - концентрация данного антибиотика (мкг/мл) в очаге инфекции (или в сыворотке крови) при введении терапевтических доз препарата.
Микроорганизм чувствителен, а антибиотик обычно клинически эффективен, если Т менее 0,3. Значения К можно найти в специальных таблицах. Пример такой таблицы представлен ниже (табл. 1).
Таблица 1
Концентрация антибиотика в сыворотке крови (мкг/мл)
после введения среднетерапевтических доз препарата (К)
| Антибиотик | Концентрация в сыворотке | Антибиотик | Концентрация в сыворотке |
| Ампициллин | 15–25 | Полимиксин В | 10–15 |
| Бензилпенициллин | 0,5–2 (ЕД/мл) | Рифампицин | 15–25 |
| Ванкомицин | 10–15 | Стрептомицин | 20–25 |
| Гентамицин | 6–8 | Тетрациклины | 3–5 |
| Канамицин | 15–20 | Тобрамицин | 6–8 |
| Линкомицин | 10–15 | Фузидиевая кислота | 10–20 |
| Метициллин | 10–15 | Хлорамфеникол | 5–10 |
| Оксациллин | 4–6 | Цефалексин | 15–25 |
| Олеандомицин | 3–5 | Эритромицин | 3–5 |
На практике величина МИК позволяет отнести исследуемый штамм микроорганизма к одной из трех общепринятых категорий: чувствительный, умеренно-устойчивый и устойчивый.
Микроорганизм считают чувствительным, если у него нет механизмов резистентности к данному антимикробному средству и при лечении стандартными дозами этого препарата отмечается хорошая терапевтическая эффективность. Устойчивым к антимикробному средству считают микроорганизм, если он имеет механизмы резистентности к данному препарату и при лечении инфекций, вызванных этим микроорганизмом, нет клинического эффекта даже при использовании максимальных терапевтических доз этого препарата. Микроорганизм относят к умеренно-устойчивым, если по своей чувствительности он занимает промежуточное значение между чувствительными и устойчивыми штаммами и при лечении инфекций, вызванных данным возбудителем, хорошая клиническая эффективность наблюдается только при использовании высоких терапевтических доз препарата (или при локализации процесса в местах концентрации антимикробного средства).
Конечно выработка критериев чувствительности/устойчивости намного более сложный процесс. При этом необходимо учитывать ряд факторов, включая особенности фармакокинетики препарата (колебание концентраций, распределение в организме, связывание с белками и др.), частоту возникновения и характер распределения устойчивых клонов в микробной популяции, скорость и равномерность роста популяции в предлагаемых условиях опыта, постэкспозиционные и предпороговые эффекты антибиотиков, концентрации кислорода и редокс-потенциал в очаге инфекции и проч. В этой связи для максимально достоверной экстраполяции результатов тестирования in vitro на клиническую эффективность требуются многочисленные и разноплановые исследования. Например, в ходе выработки критериев чувствительности по результатам дискодиффузионного метода в лабораториях CLSI (ранее NCCLS) тестируют не менее 300 штаммов одного вида в отношении одного антибиотика.
Выбор антибиотика для лечения зависит от чувствительности возбудителя (реальной и/или прогнозируемой), возможности достижения антибиотиком очага инфекции без снижения его активности, от возможного нежелательного (побочного) действия, комплаентности и доступности для больного.
МЕТОДЫ ОПРЕДЕЛЕНИЯ ЧУВСТВИТЕЛЬНОСТИ К АНТИМИКРОБНЫМ СРЕДСТВАМ
Метод серийных разведений
Методом серийных разведений МИК определяют по минимальной концентрации антибиотика, задерживающей видимый рост микроорганизма в пробирках (макрометод), лунках планшета (микрометод) или на чашках с питательной средой, содержащих убывающие концентрации антибиотика.
Например, для определения МИК тетрациклина в отношении культуры Staphylococcus aureus ,
выделенной от больного, готовят двукратно убывающие концентрации этого антибиотика в стандартном питательном бульоне (Бульон Мюллера-Хинтона). Контролями культуры и антибиотика являются, соответственно, бульон без антибиотика и бульон с первым разведением антибиотика. В опытные и контрольные пробирки вносят стандартизованную суспензию молодой агаровой культуры S. aureus и после суточной инкубации учитывают результат.
Учетным признаком является наличие или отсутствие мутности бульона (роста культуры) в пробирках.
В контроле культуры должна быть мутность, в контроле антибиотика - нет. Величина МИК соответствует той минимальной концентрации тетрациклина, при которой отсутствует мутность (бульон в пробирке прозрачен). Допустим, бульон будет мутным в опытных пробирках с концентрациями 1, 2, 4 и 8 мкг/мл, а в пробирках с концентрациями 16, 32 и 64 мкг/мл прозрачным. В этом случае МИК тетрациклина = 16 мкг/мл. Известно, что величина К тетрациклина при введении среднетерапевтических доз - 4 мкг/мл (при использовании максимальных доз - 10 мкг/мл). Следовательно, в данном случае терапевтический индекс будет равен Т = 16:4 = 4 (> 0,3), т.е. возбудитель устойчив к антибиотику и лечение тетрациклином не даст антимикробного эффекта в отношении S. aureus у данного больного, даже при введении максимальных доз (Т = 16:10 = 1,6).
Серийные разведения в плотных средах (Агар Мюллера-Хинтона, М173) чаще используют для одновременного тестирования большого количества микробных штаммов (для посева можно использовать специальный штамп-репликатор). Учетным признаком в этом случае является наличие или отсутствие роста на поверхности агара.
Метод серийных разведений нередко считают наиболее точным, хотя и относительно трудоемким, дорогим. В действительности, при правильной постановке и соответствующих контролях диффузионные методы в ряде случаев не уступают ему по точности. Вместе с тем методом серийных разведений можно тестировать чувствительность более широкого круга микроорганизмов (включая анаэробные, медленно-растущие и прихотливые).
Диско-диффузионный метод
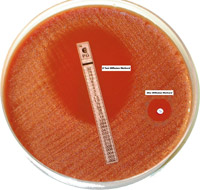
При определении чувствительности методом диффузии в агар чистую культуру возбудителя засевают «газоном» на питательный агар в чашке, например, тампоном, смоченном в стандартизованной (108 КОЕ/мл) суспензии микроорганизма. Затем на поверхность агара укладывают стандартные бумажные диски, пропитанные антибиотиками, которые диффундируют в агар, создавая градиент концентрации. На чашку диаметром 90 мм равномерно укладывают 6-7 дисков. После инкубирования в термостате измеряют диаметры зон задержки роста вокруг дисков и по специальным таблицам определяют степень чувствительности к тому или иному антибиотику (рис. 1). 
Рис. 1. Определение антибиотикочувствительности диско-диффузионным методом
Существует линейная связь между логарифмом МИК, измеренной при использовании метода серийных разведений, и диаметром зоны задержки роста при использовании диско-диффузионного метода (рис. 2).
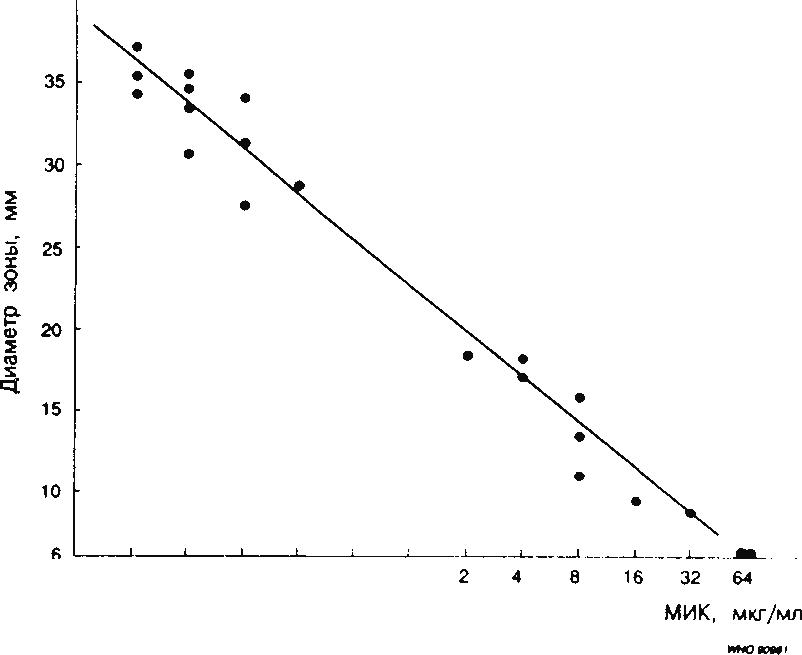
Рис. 2. Графическое изображение взаимосвязи между Iog2 МИК и диаметром зоны задержки роста, полученным с помощью диско-диффузионного метода при использовании дисков, содержащих аналогичную концентрацию антибиотика.
Поскольку для получения результатов методом диффузии в агаре используют стандартизованные условия (состав и количество среды, количество засеваемых микробов, температура и сроки инкубирования, стандартные диски и др.), каждому значению диаметра зоны вокруг диска с антибиотиком соответствует определенное значение МИК. Исходя из значения МИК, можно определить терапевтический индекс: Т=МИК/К (см. выше). Следовательно, по диаметру зоны можно определить степень чувствительности к тому или иному антибиотику: чувствительные (S), умеренно-устойчивые (I) и устойчивые (R).
К категории S (от англ. sensitive, чувствительный) относят те, для которых использование средних терапевтических доз будет достаточным для трехкратного превышения МИК.
В категорию I (от англ. intermediate, промежуточный) относят те микробы, для подавления которых потребуются максимальные терапевтические дозы.
Категорию R (от англ. resistant, устойчивый) составляют те микроорганизмы, в отношении которых данный антибиотик будет неэффективным in vivo (см. выше).
Таким образом, определение антибиотико-чувствительности методом серийных разведений и диско- диффузионным методом основаны на одном принципе - сравнении величины МИК для данного микроба со средней концентрацией антибиотика в сыворотке крови. Различие в том, что в первом случае МИК определяют непосредственно в опыте, а во втором случае определяют величину зоны задержки роста, как эквивалент МИК, поэтому цепочка расчетов несколько длиннее: диаметр-МИК-Т-категория чувствительности. Диско-диффузионный метод более прост, дешев и гибок в работе, хотя и имеет свои ограничения (см. ниже).
Другие методы
Промежуточное положение между двумя вышеописанными методами занимает метод определения чувствительности с помощью Е-тестов (E-test). Последние представляют собой бумажные полоски, пропитанные не одной, а рядом убывающих концентраций определенного антибиотика (128, 64, 32, 16, 8, 4, ...мкг/мл). Е-тесты, подобно дискам при диско-диффузионном методе, укладывают на поверхность стандартного питательного агара, засеянного испытуемой культурой в виде «газона». В результате диффузии антибиотик формирует в агаре эллипсовидную зону градиента концентраций: более широкую в области высоких концентраций и более узкую — в области низких. После инкубирования вокруг полоски формируется эллипсовидная зона задержки роста, которая, сужается в области малых концентраций и «пересекает» полоску на уровне, соответствующем величине МИК (рис. 3). Тот же принцип используется при определении чувствительности методом стрипов ХайКомб (см. ниже).
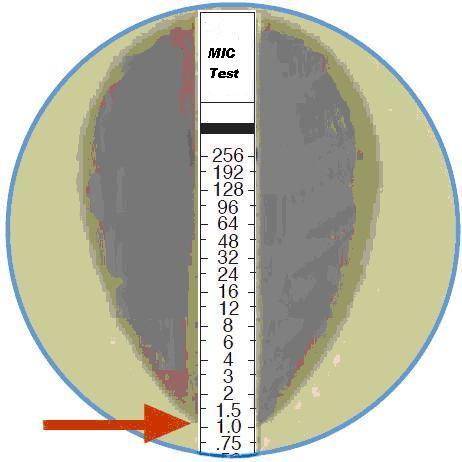 |
Рис. 3. Схема постановки Е-теста (стрелкой показано место пересечения зоны задержки |
При массовых исследованиях используют автоматизированные методы определения чувствительности к антибиотикам. Это позволяет упростить и ускорить проведение исследования. Наиболее часто применяют метод серийных разведений в планшетах и метод пограничных концентраций (микрометоды). В первом случае, как правило, используют готовые стерильные полистироловые 96-луночные планшеты, в лунки которых внесены лиофильно высушенные в бульоне убывающие концентрации антибиотиков. После вскрытия планшета стандартизованную суспензию испытуемой культуры в одинаковой дозе (например, 0,1 мл) асептически вносят в соответствующие ряды лунок, закрывают крышкой и инкубируют при оптимальной температуре. После инкубирования отмечают рост (помутнение бульона) в тех лунках планшета, где антибиотик не действует. При наличии помутнения бульона в контроле культуры и опытных лунках определяют величину МИК. Учет можно вести как визуально, так и с помощью специальных микробиологических анализаторов. В этих приборах имеется возможность автоматизации основных действий: внесения культуры, инкубирования, встряхивания, определения оптической плотности (степени мутности) жидкости в каждой лунке, графическое отображение результатов (в том числе в динамике), определение степени чувствительности и печать протокола исследования.
Метод пограничных концентраций можно считать усеченным методом серийных разведений. В соответствии с ним испытуемую культуру вносят только в две лунки (пробирки), где находятся высокая (С) и низкая (с) концентрации антибиотика. Концентрация «С» соответствует границе между устойчивыми и умеренно-устойчивыми штаммами, а концентрация «с»- границе между умеренно-устойчивыми и чувствительными штаммами. Если после инкубирования рост отсутствует в обеих лунках, штамм относят к чувствительным, если только в лунке с концентрацией «С»-к умеренно-устойчивыми штаммам, а если в обеих лунках имеется рост, штамм относят к устойчивым. Результат этого исследования имеет качественное (полуколичественное) выражение, но само исследование отличается простотой и экономичностью. Иногда вместо 2 концентраций используют одну или более 2 (неполный ряд разведений).
Многие модификации метода серийных разведений сводятся к способу учета результата: колориметрическое, турбидиметрическое, флюорометрическое исследование и др.